Что (кто) такое Межгалогенные соединения - определение
Интергалогенид; Межгалогенные соединения
Межгалогенные соединения
межгалоидные соединения, соединения галогенов друг с другом. Известные М. с. можно разделить на следующие группы: фториды (ClF, ClF3, BrF, BrF3, BrF5, IF, IF5 и IF7), хлориды (BrCl, ICl и ICl3) и бромиды (IBr). В состав молекул М. с. обычно входит не более двух различных элементов. Как правило, галогены могут образовать М. с. с тем большим числом атомов в молекуле, чем дальше они отстоят друг от друга в периодической системе Менделеева. Все М. с. можно синтезировать взаимодействием элементов; кроме того, М. с., состав которых выражается формулами от AB3 до AB7, образуются при присоединении соответствующих галогенов к М. с. состава AB. При обычных условиях ClF, ClF3 и IF3 находятся в газообразном состоянии, ICl, ICl3, IBr и BrClF6 - в твёрдом, остальные - в жидком. Из всех М. с. наименее устойчивы BrF и BrCl; другие М. с. при обычных условиях относительно стабильны, хотя в большей или меньшей степени диссоциируют на составляющие их галогены уже при температуре 25-50 °С.
По физическим и химическим свойствам М. с. имеют много общего со свободными галогенами. Однако молекулы М. с. полярны, так как состоят из элементов с различной электроотрицательностью. Поэтому, например, электропроводность твёрдых и жидких М. с. значительно выше, чем галогенов, а в растворах и расплавах молекулы М. с. всегда ассоциированы.
Химическая активность некоторых М. с. выше, чем составляющих их галогенов; ClF более реакционноспособен по отношению ко многим органическим соединениям, чем свободный фтор. Особенностью М. с. является и их ярко выраженная способность к образованию комплексных соединений как с неорганическими галогенидами (известны, например, комплексы М. с. состава KCl·ICl, BrF3·SbF3 и т. д.), так и с органическими веществами (анилином, пиридином, диоксаном и другими). Применение М. с. ограничено в основном количественным химическим анализом, где используются солянокислые растворы ICl и ICl3.
Лит.: Фиалков Я. А., Межгалоидные соединения, К., 1958.
С. С. Бердоносов.
Сераорганические соединения
Сераоргани́ческие соедине́ния — обширный класс химических соединений, содержащих в молекуле связь углерод — сера.
Сераорганические соединения
вещества, содержащие в молекуле связь углерод - сера. С. с. многочисленны и разнообразны; сера, наряду с водородом, кислородом, азотом и галогенами, - один из основных элементов-органогенов. В С. с. атом S может находиться в любой характерной для него степени окисления: S (-2), S (+4) и S (+6). Главные типы С. с. (R, R', Ar - органический остаток): 1) содержащие S (-2) - Меркаптаны (тиоспирты) RSH, Тиофенолы ArSH, тиоальдегиды R - CH=S и тиокетоны R - CS - R', Тиокислоты 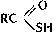 (тиоловые кислоты),
(тиоловые кислоты),  (тионовые кислоты) и
(тионовые кислоты) и 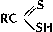 (дитиокислоты), а также их разнообразные производные, тиоэфиры (органические Сульфиды) R - S - R', ди- и полисульфиды R - Sx - R' (x ≥ 2), соли сульфония RR'S+X - (X - анион, например Cl -; см. Ониевые соединения), серосодержащие гетероциклы, например Тиофен, а также многочисленные соединения различных классов, несущие серосодержащую группировку, например меркаптоаминокислоты; 2) С. с., содержащие S (+4), - сульфиновые кислоты
(дитиокислоты), а также их разнообразные производные, тиоэфиры (органические Сульфиды) R - S - R', ди- и полисульфиды R - Sx - R' (x ≥ 2), соли сульфония RR'S+X - (X - анион, например Cl -; см. Ониевые соединения), серосодержащие гетероциклы, например Тиофен, а также многочисленные соединения различных классов, несущие серосодержащую группировку, например меркаптоаминокислоты; 2) С. с., содержащие S (+4), - сульфиновые кислоты 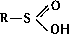 и сульфоксиды RSOR'; 3) содержащие S (+6), - сульфокислоты RSO3H и сульфоны R - SO2 - R'.
и сульфоксиды RSOR'; 3) содержащие S (+6), - сульфокислоты RSO3H и сульфоны R - SO2 - R'.
Основные методы синтеза С. с. основаны на реакциях органических соединений с элементарной серой или её простейшими неорганическими соединениями:
H2S, Na2S, NaSH, SCI2, SO2, SO3, H2SO4.
Ниже приведены схемы некоторых реакций:
Ar - H + H2SO4 → ArSO3H + H2O
Большое значение имеют также методы, основанные на взаимных превращениях С. с.
К С. с. принадлежат многие важные природные вещества, например аминокислоты Цистеин и Метионин, ряд коферментов (См. Коферменты) (кофермент А, липоевая кислота), витаминов (тиамин, биотин), антибиотиков (например, Пенициллины). Сульфгидрильные группы цистеина играют важную роль в активном центре многих ферментов. Дисульфидные связи цистина, образующиеся в результате связывания двух остатков цистеина, участвуют в поддержании пространственной структуры белков (См. Белки) и пептидов. К С. с. относятся также многочисленные лекарственные и физиологически активные синтетические вещества, в том числе Сульфаниламидные препараты, Радиозащитные средства (цистамин, цистафос и др.), инсектофунгициды и ростовые вещества, отравляющие вещества (иприт), Красители различных классов - сернистые, некоторые анилиновые, антрахиноновые, фталоцианиновые. Как С. с. можно рассматривать и некоторые высокомолекулярные соединения, например Полисульфидные каучуки (тиоколы); на образовании С. с. основана Вулканизация каучуков серой (и сё производными). С. с. используются в качестве ингибиторов полимеризации и окисления, стабилизаторов полимерных материалов (меркаптобензимидазол и др.), растворителей (тетраметиленсульфон, диметилсульфоксид). Соли органических сульфокислот применяют как поверхностно-активные вещества (Моющие средства). Многие С. с., например ароматические сульфокислоты, - важные полупродукты основного органического синтеза.
Б. Л. Дяткин.
Википедия
Интергалогениды
Интергалогени́ды — соединения галогенов между собой. Они также называются межгалоге́нными соедине́ниями. Межгалогенные соединения могут существовать в четырёх стехиометрических соотношениях: XY, XY3, XY5 и XY7, где Y — это более химически активный галоген. Исключением является неустойчивый гексафторид брома BrF6. Наиболее устойчивы среди них моногалогениды состава XY (кроме монофторида брома и монофторида иода).
